[Effetti dell’elettrochemioterapia sulla vascolarizzazione tumorale: implicazioni nel trattamento delle metastasi sanguinanti]
Tomaz Jarm1, Maja Cemazar2, Damijan Miklavcic1 and Gregor Sersa2
1University of Ljubljana, Faculty of Electrical Engineering, Trzaska 25, SI-1000 Ljubljana, Slovenia
2Institute of Oncology Ljubljana, Zaloska 2, SI-1000 Ljubljana, Slovenia
Expert Rev. Anticancer Ther. 10(5), 729–746 (2010)
Tumori solidi di varia eziologia possono essere efficacemente trattati con l’elettrochemioterapia (ECT), l’uso combinato di elettroporazione (EP) e farmaci chemioterapici (bleomicina e cisplatino). In clinica, l’efficacia antitumorale dell’ECT è stata ampliamente provata nel trattamento delle metastasi da melanoma dove si è ottenuta una risposta completa nel 70–80% dei casi.
Gli effetti dell’elettrochemioterapia, oltre al ben noto incremento dell’efficacia del farmaco chemioterapico, sembrano implicare anche modifiche del flusso sanguigno e della vascolarizzazione a livello tumorale …
La somministrazione intratumorale o endovenosa di farmaci chemioterapici poco permeanti (bleomicina o cisplatino) seguita dalla elettroporazione locale del tessuto (EP) viene denominata elettrochemioterapia (ECT). La EP facilita l’entrata del farmaco nelle cellule, producendo di fatto un potenziamento locale di diversi ordini di grandezza dell’effetto citotossico del farmaco.
In clinica, l’efficacia antitumorale dell’ECT è stata ampliamente documentata nel trattamento delle metastasi da melanoma dove si è ottenuta una risposta completa nel 70 –80% dei casi.
L’EFFETTO ANTIVASCOLARE DI EP ED ECT
Gli effetti dell’elettrochemioterapia, oltre al ben noto incremento dell’efficacia del farmaco chemioterapico, sembrano implicare anche modifiche del flusso sanguigno e della vascolarizzazione a livello tumorale.
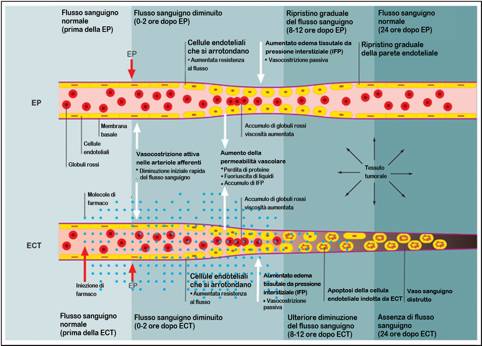
Sono stati evidenziati due effetti distinti: si verifica in una prima fase una riduzione del flusso sanguigno e una vasocostrizione del tessuto, seguita da una seconda fase, più duratura della prima, di perturbazione della vascolarizzazione tumorale.
L’effetto “vascular lock”
L’elettroporazione (EP) induce una rapida, profonda, ma transitoria riduzione del flusso sanguigno che si esplica in due fasi:
- La prima fase è istantanea, radicale (una quasi complete chiusura del flusso sanguigno), ma breve (qualche minuto) e produce una vasocostrizione delle arteriole efferenti la zona interessata all’EP.
- La seconda fase è più lenta, meno radicale, ma duratura (24 ore) ed è il risultato di una transitoria alterazione delle strutture cito-scheletriche e della compromissione della funzione barriera dell’endotelio micro vascolare.
L’effetto “vascular disrupting”
L’ECT produce, in aggiunta agli effetti generati dalla sola EP, un ulteriore diminuzione del flusso sanguigno che causa la morte di una quota addizionale di cellule tumorali dovuta ad una prolungata mancanza di ossigeno e sostanze nutritive e all’accumulo di sostanze di rifiuto nel tumore.
Questo effetto “vascular-disrupting” permette di completare l’eliminazione del tumore uccidendo le cellule che non erano state distrutte direttamente dal farmaco, vuoi perché la zona non fosse stata efficacemente elettroporata, voi perché non si era raggiunta una insufficiente concentrazione extracellulare di farmaco.
In breve
Gli effetti “vascular lock” e “vascular-disrupting” contribuiscono alla efficace eliminazione del tumore in due modi:
- Effetto “vascular lock”: causando una prolungata esposizione delle cellule tumorali al farmaco dovuto al suo intrappolamento;
- Effetto “vascular disrupting”: causando l’eliminazione di una quota addizionale di cellule tumorali dovuta ad una prolungata mancanza di ossigeno e nutrimenti e all’accumulo di sostanze di rifiuto nel tumore.
Gli effetti “vascular lock” e “vascular disrupting” vengono sfruttati appieno nel controllo di metastasi da melanoma, o da altro tumore, sanguinanti. Immediatamente dopo l’ECT, il sanguinamento si ferma senza riprendere.
Il ruolo dei due effetti sopracitati si stima possa contribuire in modo cruciale, insieme alla risposta immune, alla spesso osservata risposta completa e duratura nel tempo dei tumori trattati con ECT.
La sequenza di eventi che interferiscono con il flusso sanguigno tumorale dopo EP da sola o dopo ECT sono descritti nella Figura 1.
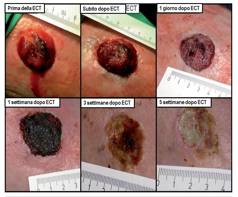
ECT DI METASTASI DA MELANOMI SANGUINANTI
|
Le metastasi da melanoma ricorrenti, spesso doloranti e ulcerate, talvolta sanguinanti, rappresentano un problema per il medico, perché difficilmente trattabili con successo, e per il paziente, perché sono fonte di disagio psicologico e di forte stress.
Tra i trattamenti disponibili per la metastasi sanguinanti l’ECT offre molti vantaggi al paziente:
- Si effettua in una sola seduta.
- Offre una alta probabilità di successo e di sollievo immediate,
- Si può effettuare in regime di Day Surgery.
Grazie agli affetti sulla vascolarizzazione tumorale l’ECT può essere considerate una modalità di trattamento in pazienti con noduli da melanoma sanguinanti refrattari. |
Gli effetti sulla vascolarizzazione tumorale esercitati dall’ECT assumono grande importanza nel trattamento dei tumori non accessibili dalla cute, specialmente in organi ben vascolarizzati, come per esempio il fegato, dove l’ECT può prevenire il sanguinamento delle aree trattate.
Bibliografia
- Sersa G, Jarm T, Kotnik T, Coer A, Podkrajsek M, Sentjurc M, Miklavcic D, Kadivec M , Kranjc S, Secerov and Cemazar M (2008)Vascular disrupting action of electroporation and electrochemotherapy with bleomycin in murine sarcoma. Br. J. Cancer 98(2), 388–398
- Belehradek Jr J, Orlowski S, Ramirez LH, Pron G, Poddevin B, Mir LM (1994) Electropermeabilization of cells and tissues assessed by the quantitative and qualitative electroloading of bleomycin. Biocim Biophys Acta 1190: 155 –163
- Bokoch GM, Bohl BP, Chuang TH (1994) Guanine nucleotide exchange regulates membrane translocation of Rac/Fho GTP-binding proteins. J Biol Chem 269: 31674–31679
- Cemazar M, Golzio M, Sersa G, Rols MP, Teissie J (2006) Electricallyassisted nucleic acids delivery to tissues in vivo: where do we stand? Curr Pharm Des 12: 3817–3825
- Cemazar M, Miklavcic D, Scancar J, Dolzan V, Golouh R, Sersa G (1999) Increased platinum accumulation in SA-1 tumour cells after in vivo electrochemotherapy with cisplatin. Brit J Cancer 79: 1386–1391
- Cemazar M, Parkins CS, Holder AL, Chaplin DJ, Tozer GM, Sersa G (2001) Electroporation of human microvascular endothelial cells: evidence for anti-vascular mechanism of electrochemotherapy. Br J Cancer 84:556–570
- Delorme S, Krix M (2006) Contrast-enhanced ultrasound for examining tumor biology. Cancer Imaging 6: 148–152
- Duck FA (1990) Physical Properties of Tissue. New York: Academic Press
- Engstrom PE, Ivarsson K, Tranberg KG, Stenram U, Salford LG, Persson BR (2001) Electrically mediated drug delivery for treatment of an adenocarcinoma transplanted into rat liver. Anticancer Res 21(3B): 1817– 1822
- Gabriel S, Lau RW, Gabriel C (1996) The dielectric properties of biological tissues. II. Measurements in the frequency range 10 Hz–20 GHz. Phys Med Biol 41: 2251–2269
- Geddes LA, Barker LE (1967) The specific resistance of biological material –a compendium of data for the biomedical engineer and physiologist. Med Biol Eng 5: 271–293
- Gehl J, Geertsen PF (2006) Palliation of haemorrhaging and ulcerated cutaneous tumours using electrochemotherapy. Eur J Cancer Suppl 4(11): 35–37
- Gehl J, Skovsgaard T, Mir LM (2002) Vascular reactions to in vivo electroporation: characterization and consequences for drug and gene delivery. Biochim Biophys Acta 1569: 51–58
- Heller LC, Heller R (2006) In vivo electroporation for gene therapy. Hum Gene Ther 17: 890–897
- Heller R, Gilbert R, Jaroszeski MJ (1999) Clinical applications of electrochemotherapy. Adv Drug Deliv Rev 35(1): 119– 129
- Hinnen P, Eskens FALM (2007) Vascular disrupting agents in clinical development. Brit J Cancer 96: 1159–1165
- Hirsch FG, Clinton EC, Wood LA, Ballard WC, Horan FE, Wright IS (1950) The electrical conductivity of blood. I. Relationship to erythrocyte concentration. Blood 5: 1017–1035
- Jarm T, Sersa G, Miklavcic D (2002) Oxygenation and blood flow in tumors treated with hydralazine: evaluation with a novel luminescence-based fiber-optic sensor. Technol Health Care 20: 363–380
- Kanthou C, Kranjc S, Sersa G, Tozer G, Zupanic A, Cemazar M (2006) The endothelial cytoskeleton as a target of electroporation based therapies. Mol Cancer Ther 5: 3145–3152
- Kanthou C, Tozer GM (2002) The vascular disrupting agent combretastatin A-4 phosphate induces reorganisation of the actin cytoskeleton and early membrane blebbing in human endothelial cells. Blood 99: 2060–2069
- Kotnik T, Bobanovic F, Miklavcic D (1997) Sensitivity of transmembrane voltage induced by applied electric fields – a theoretical analysis. Bioelectrochem Bioenerg 43: 285–291
- Kotnik T, Miklavcic D (2000) Analytical description of transmembrane voltage induced by electric fields on spheroidal cells. Biophys J 79: 670–679
- Krzic M, Sentjurc M, Kristl J (2001) Improved skin oxygenation after benzyl nicotinate application in different carriers as measured by EPR oximetry. J Cont Release 70: 203–211
- Marty M, Sersa G, Garbay JR, Gehl J, Collins CG, Snoj M, Billard V, Geertsen PF, Larkin JO, Miklavcic D (2006) Electrochemotherapy – an easy, highly effective and safe treatment of cutaneous and subcutaneous metastases: results of ESOPE (European Standard Operating Procedures of Electrochemotherapy) study. Eur J Cancer Suppl 4(11): 3–13
- Miklavcic D, Beravs K, Semrov D, Cemazar M, Demsar F, Sersa G (1998) The importance of electric field distribution for effective in vivo electroporation of tissues. Biophys J 74: 2152–2158
- Miklavcic D, Corovic S, Pucihar G, Pavselj N (2006) Importance of tumour coverage by sufficiently high local electric field for effective electrochemotherapy. Eur J Cancer Suppl 4(11): 45–51
- Mir LM (2006) Bases and rationale of the electrochemotherapy. Eur J Cancer Suppl 4(11): 38–44
- Neumann E, Schaefer-Riddler M, Wang Y, Hofschneider PH (1982) Gene transfer into mouse myeloma cells by electroporation in high electric fields. EMBO J 1: 841–845
- O’Hara JA, Blumenthal RD, Grinberg OY, Demidenko E, Grinberg S, Wilmot CM, Taylor AM (2001) Response to radioimmunotherapy correlates with tumor pO2 measured by EPR oximetry in human tumor xenografts. Rad Res 155: 466–473
- Patterson DM, Rustin GJS (2007) Vascular damaging agents. Clin Oncol 19: 443–456
- Ramirez LH, Orlowski S, An D, Bindoula G, Dzodic R, Ardouin P, Bognel C, Belehradek Jr J, Munck JN, Mir LM (1998) Electrochemotherapy on liver tumours in rabbits. Br J Cancer 77(12): 2104–2111
- Sersa G (2006a) The state-of-the-art of electrochemotherapy before the ESOPE study: advantages and clinical uses. Eur J Cancer Suppl 4(11):52–59
- Sersa G, Beravs K, Cemazar M, Miklavcic D, Demsar F (1998) Contrast enhanced MRI assessment of tumor blood volume after application of electric pulses. Electro-Magnetobiol 17: 299 –306
- Sersa G, Cemazar M, Miklavcic D, Chaplin DJ (1999a) Tumor blood flow modifying effect of electrochemotherapy with bleomycin. Anticancer Res 19: 4017–4022
- Sersa G, Cemazar M, Miklavcic D, Rudolf Z (2006b) Electrochemotherapy of tumours. Radiol Oncol 40: 163–174
- Sersa G, Cemazar M, Parkins CS, Chaplin DJ (1999b) Tumour blood flow changes induced by application of electric pulses. Eur J Cancer 35: 672–677
- Sersa G, Krzic M, Sentjurc M, Ivanusa T, Beravs K, Kotnik V, Coer A, Swartz HM, Cemazar M (2002) Reduced blood flow and oxygenation in SA-1 tumours after electrochemotherapy with cisplatin. Br J Cancer 87: 1047– 1054
- Shaked Y, Kerbel RS (2007) Antiangiogenic strategies on defense: on the possibility of blocking rebounds by the tumor vasculature after chemotherapy. Cancer Res 67: 7055–7058
- Shepherd AP, Oberg PA (eds). (1990) Laser-Doppler Blood Flowmetry.
- Kluwer: Dordrecht Siemann DW, Bibby MC, Dark GG, Dicker AP, Eskens FA, Horsma MR, Marme D, Lorusso PM (2005) Differentiation and definition of vasculartargeted therapies. Clin Cancer Res 11: 416–420
- Swartz HM, Boyer S, Brown D, Chang K, Gost P, Glockner JF, Hu H, Lin KJ, Moussavi M, Nilges M, Norby SW, Smirnow A, Vahidi N, Walzcak T, Wu M, Clarckson RB (1993) The use of EPR for the measurement of the concentration of oxygen in vivo in tissues under physiologically pertinent conditions and concentrations. In: Oxygen Transport to Tissue XIV, Nemoto M and La Mana C (eds), pp. 221–228. New York: Plenum Press
- Swartz HM, Clarkson RB (1998) The measurement of oxygen in vivo using EPR techniques. Phys Med Biol 43: 1957–1975
- Tozer GM, Kanthou C, Baguley BC (2005) Disrupting tumour blood vessels. Nature Rev Cancer 5: 423–435
- Tozer GM, Prise VE, Wilson J, Cemazar M, Shan S, Dewhrist MW, Barber PR, Vojnovic B, Chaplin DJ (2001) Mechanisms associated with tumour vascular shut-down induced by combretatstatin A-4 phosphate: Intravital microscopy and measurement of vascular permeability. Cancer Res 61: 6413–6422

IGEA S.p.A. Via Parmenide 10/A, 41012 CARPI (MO) ITALY | Phone: +39-(0)59-699600 | Fax: +39-(0)59-695778 | info@igeamedical.com | www.igeamedical.com

